Inhalt
Natriumacetat-Trihydrat ist eine übliche und kostengünstige Verbindung, die für verschiedene Anwendungen in Lebensmitteln, Industrie und Labor verwendet wird. Es wird beim Beizen, beim Gerben, als Puffer und als Hauptkomponente von elektrischen Kompressen verwendet. Natriumacetat wird zur Verwendung bei der Denitrifikation von Abwasser als Bestandteil von Nematiziden untersucht.
Vorbereiten
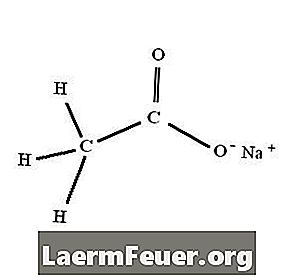
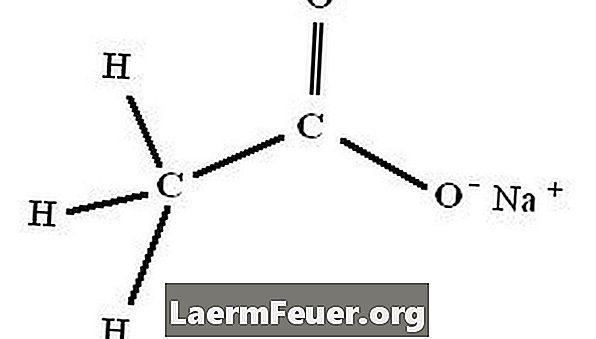
Natriumacetat-Trihydrat, chemische Formel NaC2H3O2.3H2O, wird sofort durch die Reaktion zwischen Essigsäure (Essig) und Natriumhydroxid, Natriumcarbonat oder Natriumbicarbonat gebildet.
Name und Formel
Der wissenschaftliche Name für Essigsäure ist Ethansäurealkohol. Aus diesem Grund wird Natriumacetat manchmal als Natriumethanoat bezeichnet.
Organische Chemikalien schreiben die Struktur von Natriumacetat als NaCl2H3O2.3H2O vor. In einigen Situationen verwenden sie jedoch die abgekürzte Schreibweise "NaAc".
Verwendung von Lebensmitteln
In einem Verhältnis von Eins zu Eins können Natriumacetat und Essigsäure in einem als Natriumdiacetat bezeichneten Produkt mitkristallisiert werden. Dieses Produkt ist in der Lebensmittelindustrie sehr nützlich, da es fast geruchlos ist und sich "in situ" in seine Bestandteile zersetzt. Sowohl Natriumacetat als auch Diacetat waren von der Food and Drug Administration GRAS ("allgemein als sicher anerkannt").
Natriumacetat wird in der Fleisch- und Geflügelindustrie verwendet, um den Geschmack zu verbessern. Diacetat wird für einen ähnlichen Zweck und als Wachstumsinhibitor von Pathogenen verwendet.
Medizinische Verwendung
Natriumacetat wird in der Medizin zur Gewinnung von Elektrolyten verwendet. Es dient auch als Diuretikum.
Die interessanteste Anwendung davon ist in elektrischen Kompressen. Natriumacetat-Trihydrat enthält drei Kristallisationsmoleküle. Erwärme es auf 58 Grad Fahrenheit und dieses Wasser wird aus dem Kristall freigesetzt. Sie lösen das entwässerte Natriumacetat auf und ersetzen den Feststoff durch eine Lösung. Diese Lösung kann ohne Umkristallisation auf Raumtemperatur abgekühlt werden. Wenn gewünscht, kann diese Flüssigkeit bei ausreichender Stimulation erneut zur Kristallisation gezwungen werden. Die Kristallisation setzt durch Erwärmen des gewünschten Körperteils Wärme frei.
Industrieller Einsatz
Natriumacetat ist ein alkalisches Salz, das Produkt der Reaktion einer starken Base mit einer schwachen Säure. Daher ist es aufgrund seiner Basizität sowie seiner geringen Kosten attraktiv für die Neutralisierung von industriellen Mineralsäuren.
Bei der Schädlingsbekämpfung wird Natriumacetat als Bestandteil von Nematiziden untersucht. Nematoiden können von Natriumacetat wie von einem Köder angezogen werden, ebenso wie Insekten von Pheromonen.