Inhalt
- Anweisungen
- Anzahl der Elektronen in der Valenzschicht
- Lewis-Struktur
- Formelle Ladung jedes Atoms
- Hinweis
- Was du brauchst
Bei der Bestimmung der formalen Ladung eines Moleküls wie CoCl2 (Phosgengas) ist es notwendig, die Anzahl der Elektronen in der Valenzschicht jedes Atoms und die Lewis-Struktur des Moleküls zu kennen.
Anweisungen

-
Suchen Sie nach jedem Atom im Periodensystem der Elemente, um die Anzahl der Elektronen in der Valenzschicht zu bestimmen.
-
Es sei daran erinnert, dass sich zwei Elektronen in der ersten Unterebene s befinden, zwei in der zweiten Unterebene s, sechs Elektronen in der ersten Unterebene p und so weiter. Rückruf: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
-
Treffen Sie die Ladung. Wenn das Molekül ein Ion ist, addieren oder subtrahieren Sie ein oder mehrere Elektronen von der Summe, um die endgültige Ladung zu erreichen.
-
Für CoCl 2 (Phosgengas): C = 4; O = 6; Cl = 7. Das Molekül ist nicht ionisiert und hat eine neutrale Ladung. Daher beträgt die Gesamtzahl der Elektronen in der Valenzschicht 4 + 6 + (7x2) = 24.
Anzahl der Elektronen in der Valenzschicht
-
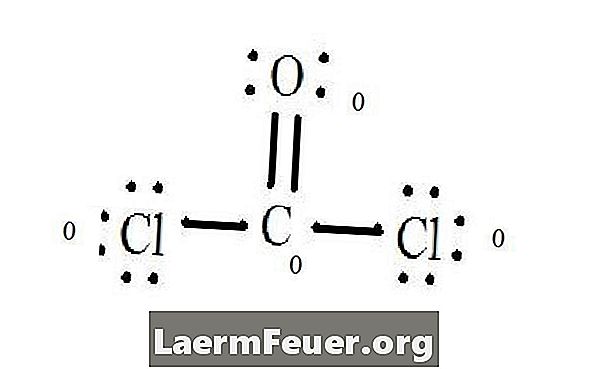
Siehe das Lewis-Strukturdiagramm von CoCl2 (Phosgengas). Die Lewis-Struktur stellt die stabilste und wahrscheinlichste Struktur für das Molekül dar. Atome werden mit gepaarten Valenzelektronen gezeichnet; Bindungen werden zwischen freien Elektronen gebildet, um die Oktettregel zu erfüllen.
-
Zeichnen Sie jedes Atom und seine Valenzelektronen und bilden Sie nach Bedarf Bindungen.
Elektronen auf der Lewis-Struktur gezeichnet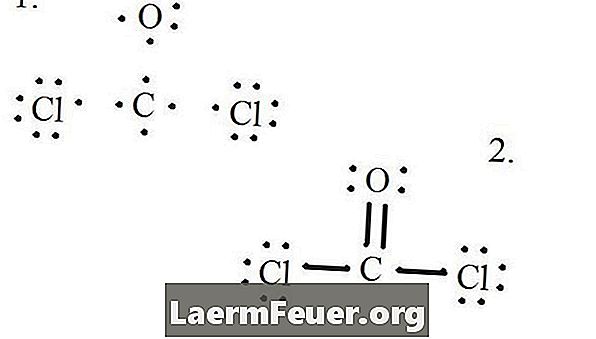
-
Chloridatome teilen Einfachbindungen mit dem Kohlenstoffmolekül, während das Sauerstoffatom eine Doppelbindung mit Kohlenstoff bildet. Jedes Atom in der Endstruktur erfüllt die Oktettregel und hat acht Elektronen in der Valenzschicht, die molekulare Stabilität ermöglichen.
Lewis-Struktur
-
Zählen Sie die freien Elektronenpaare jedes Atoms in der Lewis-Struktur. Jedes Atom bezeichnet ein Elektron jeder Bindung, an dem es beteiligt ist. Addiere diese Zahlen. In CoCl2: C = 0 freie Paare plus 4 Bindungselektronen = 4 Elektronen. O = 4 Elektronen von freien Paaren plus 2 Elektronen von Bindungen = 6 Elektronen. Cl = 6 Elektronen freier Paare plus ein Elektron einer Bindung mit C = 7 Elektronen.
-
Subtrahieren Sie die Anzahl der Elektronen in der Valenzschicht des ungebundenen Atoms. Das Ergebnis ist die formelle Ladung für jedes Atom. Im CoCl2: C = 4 Valenzelektronen (ev) im ungebundenen Atom minus 4 in der Lewis-Struktur (LS) bezeichneten Elektronen = 0 Formalladung O = 6 ev - 6 LS = 0 Formalladung Cl = 7 und - 7 LS = 0 formale Gebühr
Formelle Ladung von Atomen
-
Platzieren Sie diese Ladungen beim Schreiben in der Nähe der Atome in der Lewis-Struktur. Wenn das Molekül insgesamt eine Ladung hat, platzieren Sie die Lewis-Struktur in Klammern. Die Ladung ist außen in der oberen rechten Ecke angegeben.
Formelle Ladung jedes Atoms
Hinweis
- Die Berechnung der Formalladung für Moleküle, die Übergangsmetalle enthalten, kann tückisch sein. Die Anzahl der Elektronen in der Valenzschicht für Übergangsmetalle ist diejenige außerhalb des Edelgasmusters.
Was du brauchst
- Periodensystem der Elemente